ALevel化学知识点解析—赫斯定律
赫斯定律(英语:Hess's law),又名反应热加成性定律(the law of additivity of reaction heat):若一反应为二个反应式的代数和时,其反应热为此二反应热的代数和。也可表达为在条件不变的情况下,化学反应的热效应只与起始和终了状态有关,与变化途径无关。它是由俄国化学家Germain Hess发现并用于描述物质的热含量和能量变化与其反应路径无关,因而被称为赫斯定律。今天A加未来小编就带大家一起来解析一下ALevel化学知识点中关于赫斯定律的介绍,希望能够帮助大家更好的开展课程复习。
在A-Level第六章节初始,我们会接触到一个概念叫“焓”(Enthalpy),它指的是一份物质所具有的能量,用焓=内能+压强*体积来表示。然而对于焓的理解是比较抽象的,但理解焓的差值“焓变”就容易多了。
很多化学反应,在反应前后会有温度变化,例如木炭燃烧、硝酸铵结冰等。这就代表了吸热或放热反应中的能量得失。这部分能量我们就称之为“焓变”。例如我们在室外燃烧一小块炭生成CO2放出10kJ热量,那么这部分能量就用∆H来表示,代表燃烧过程中逸散到空气中的热量。反应产生的能量变化可以是不同形式的,包括热量、光、体积变化等等,但这些能量的变化,我们都可以称之为“焓变”。
焓变也有不同的形式,例如反应焓、形成焓、燃烧焓、中和焓和原子化焓等,这些焓有些是可以实际测量的,也有些是我们为了计算而虚构的,实际反应可能并不存在。
那么在引入了焓的概念以及各类焓的定义之后,就来看看他在我们的题目里是怎么应用的吧。在此之前,我们需要理解Hess’s Law是如何运用的。
对于一个化学反应,总能量变化是一定的,无论经过几步反应,或者经过什么反应路径,甚至是虚构的中间步骤。类似于物理或者数学中的向量,无论你经过几个(连续的)步骤,只要起点和终点是相同的,向量和也就相同。
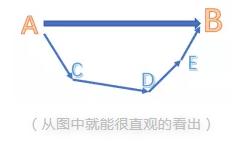
以上就是A加小编关于Alevel化学知识点——赫斯定律的介绍,大家有没有理解和掌握呢?更多ALevel课程学习问题,欢迎随时咨询我们!
A加未来国际教育作为国际课程辅导中心(A-level、IGCSE、IB、AP等国际课程),是中国最专业、最值得信赖的国际课程学习中心,是中国学生通往海外顶尖名校的桥梁。详情可以扫描下方图片上的二维码咨询。

 喜欢 [0]
喜欢 [0] 相关推荐

猜你喜欢 More

2020-10-12
AP微积分考试准备信息指导,如何做好规划?
2019-12-24
AS阶段三角函数的Alevel数学知识点总结
2020-05-06
如何科学的开展ALevel科目选择?
2022-06-06
GCSE怎么取得高分,前往英国就读















 官方微信
官方微信

 官方微博
官方微博
