AP化学知识点辅导——Thermochemistry
中国人喜欢热闹,无论是红白喜事还是节日庆祝都往往会放鞭炮作为一种仪式,那么噼里啪啦的鞭炮到底是如何实现的呢?今天A+国际教育小编要讲的AP化学知识点就和鞭炮内部的反应原理有关,那就是Thermochemistry(化学热力学)
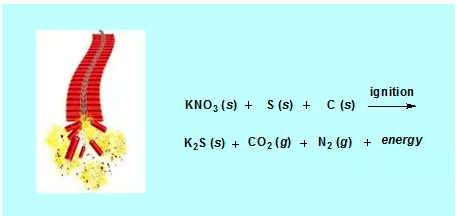
鞭炮中黑色粉末的化学成分有硝酸钾(KNO3),炭黑或糖,还有硫磺。其中硫磺、炭黑或糖(都含有碳)作为燃料或还原剂,硝酸钾作为氧化剂。在点燃鞭炮后,由于反应生成的二氧化碳和氮气急速增多,当压力达到一定程度时会将外面紧密包裹的纸筒撑破,发出“嘭”的响声,同时释放出大量热量。在这个化学反应中产生的热量的变化就是化学热力学所研究的对象。

如果下个准确的定义,那么热力学研究的就是一切物理变化和化学反应过程中能量的变化。这里说的能量有多种形式,比如鞭炮释放后不仅放出热能,同时我们会看到闪光(光能)。其它的能量类型包括机械能,电能,化学能等。虽然能量的种类繁多,但是如果我们从分子水平考虑,所有类型的能量都可以被归为动能(kinetic energy)或势能(potential energy)。顾名思义,动能即运动的能量;而势能则为储存的能量。
对于宏观静止的物质,我们把其具有的所有能量称为内能(internal energy,用E表示)。内能包括物质的分子、原子的移动、震动和转动能,电子、离子和分子间的相互吸引和排斥的势能等。在化学热力学中,我们并不关心物质在某一状态下所具有的内能的绝对值(这个值很难测定),我们真正感兴趣的是在物理和化学过程中物质内能的改变值(ΔE),这也就引出了热力学第一定律(the first law of thermodynamics):
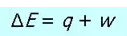
在一切过程中的能量的传递都可以变现为热(q)和功(w)。热是由于温度差别而传递的能量;而功可认为是除热之外所有以其他形式传递的能量。我们可以用下面的一个实验形象地解释热和功。把一勺粉状干冰(就是固态的二氧化碳,哈根达斯的外卖就有用干冰包装以保持冰激凌的低温)加入保鲜袋中,然后将封口关闭,并在袋子的上面放置一本书(a)。过一会儿,因为干冰温度低于室温,会从外界吸收热量而升华,变为气态的二氧化碳,从而将保鲜袋撑的鼓起来(b),使放在袋子上的书势能增加。

在从a到b的过程中,我们把干冰(所研究的物质系统)称为体系(system),干冰外的所有物质(体系之外的所有部分)称为环境(surroundings),体系加环境就是我们的自然界或宇宙(universe)。在这个实验中,体系(干冰)从环境中吸收了热量,并对环境做功。

人们按习惯把热和功在过程中发生变化后的正负符号规定如下:
我们可以这样记忆热和功的符号规律:把系统想象成你的银行账户,当有钱存入时(体系吸收热量或环境对体系做功)账户余额增加,所以这两种过程对体系而言都为正;当从账户中取钱后(体系放出热量或体系对环境做功)账户余额减少,对应的过程为负。
热力学第一定律也可以表述为能量守恒定律:自然界中的总能量是恒定不变的(The total amount of energy in the universe is constant)。也就是说,能量可以在不同的物质间传递,也会以不同的形式相互转化,但这些能量在传递和转化的过程中不会增多,也不会减少,总能量保持不变。这可以用下面的公式表述:

在了解了热力学第一定律后,我们该如何描述所感兴趣的体系的热力学状态(thermodynamic state)呢?这就需要介绍我下面要讲的状态函数(state functions)。

状态函数就是定义体系热力学状态的一系列参数,例如温度、压力、体积等。状态函数的大小只和体系所处的状态有关,两个不同热力学状态间状态函数的差值只由两状态决定,与体系如何有一个状态达到另一个状态的途径无关。比如你的银行账户余额在月初时是100元,月末时是300元。你可能在一个月中只做了一笔存款(200元)的业务;也可能先取出100元,又存入300元。但是你的账户余额在月初和月末的差值都是200元,这和你采用上述两条途径中的哪一条没有关系。
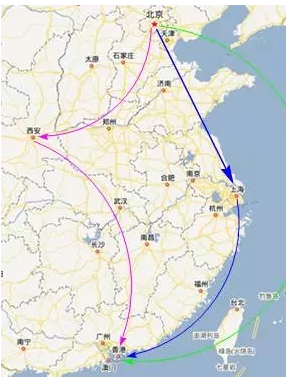
例如春节一家三口从北京到香港旅游。爸爸乘飞机直接到香港;妈妈需要先乘飞机到西安开会,然后再飞到香港;女儿则先要和同学乘火车到上海游览后再坐飞机到香港。北京到香港约2160公里,北京经上海到香港约2350公里,北京经西安到香港约2520公里。虽然三人的路径不同,但北京和香港间的距离是一定的(可以看做状态函数,state function),不同的是三人从北京到香港各自所经历的旅程(称为路径函数,path function)。
P,V,T,E都是state function,但是q和w是path function,因为不同路径可以产生不同的热或功。
在自然界中发生的大部分化学反应,例如在植物体内将二氧化碳和水合成有机化合物的光合作用,以及食物在动物体内的消化过程等等,都是在恒定气压条件下进行的。我们把在恒定压力条件下反应中的热量变化用qp来表示。但是因为反应进行的过程中可能会有功的变化(还记得热力学第一定律吗?ΔE=q+W),所以qp并不能和反应中的能量变化(ΔE)划等号。那么,如果我们定义一个新的热力学函数,将这个新函数和qp直接等同,不就可以省去了计算反应中功的麻烦了?
这就是我们要介绍的第一个新函数:焓(enthalpy),用大写H表示。

也就是说,化学反应在恒压条件下的反应热等于反应的焓变:qp=ΔH
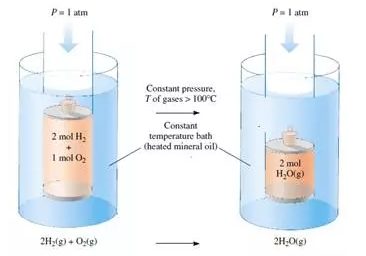
那么,怎样用数学公式把反应的焓与能量和功的变化联系在一起?回答这个问题之前,我们首先要介绍一种与恒压反应相关的功:体积功。化学反应,尤其是涉及到气体参与的反应,在外界压力不变时反应体系的体积通常会膨胀或收缩。例如,想象在温度高于100摄氏度的油浴中,2摩尔氢气和1摩尔氧气在一个封闭的圆柱体内反应生成2摩尔的水汽,圆柱体上部的活塞可以自由移动。由于反应后的体积减少为原来体积的2/3,在外界恒定大气压(1atm)作用下,环境会压缩反应体系并对其做功,我们把因体系体积改变而做的功称为体积功。体积功的大小由外界气压和体系体积的变化决定:

上边这个公式大家可能在物理课上已经很熟悉了,但是为什么要在PΔV的前面加一个负号呢?

当体系的体积减小(compression)时,ΔV为负值,P为正值,所以功为正值;类似的,当体系的体积增大(expansion)时,ΔV为正值,P为正值,所以功为负值。可见,这与我们在上一次讲到的人们对功的符号的定义(对体系而言,体系对环境做功为负,而环境对体系做功为正)相符。
在了解了体积功后,我们可以这样来表达热力学第一定律:
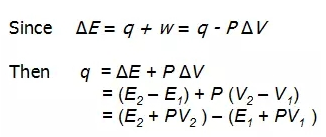
从这个公式中我们定义了焓这个新的状态函数,也就是:
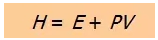
类似于体系的内能,体系在某个状态时焓的绝对值不是我们关心的对象,我们更感兴趣的是体系在经历化学反应或物理变化的过程中焓的变化值ΔH。如果反应中的反应物和产物都处于热力学标准状态(thermodynamic standard state),我们在焓的符号右上角加个0,用ΔH 0表示。

下面我们讲个在AP化学考试中经常出现的知识点:盖斯定律(Hess’s Law)。

如果一个反应分为若干步进行,那么反应的总焓变等于每步焓变之和。也就是说,反应的焓变和反应是经一步进行或是经多步进行无关,不同反应途径得到的焓变值相等。大家是不是觉得这个定律似曾相识?对了,这是状态函数的特点(殊途同归变化等),因为焓是个状态函数,所以盖斯定律也可以看作是对焓作为状态函数的体现。
下面我们通过一个例子来看看盖斯定律在计算化学反应热焓中的应用:
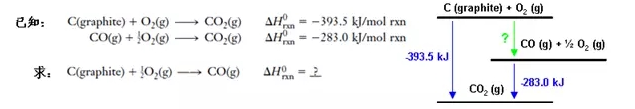
我们知道,CO是C在氧气中的不完全燃烧产物,因为生成的CO会继续与O2反应生成CO2,我们很难控制反应停留在CO阶段,所以无法直接用实验方法测定这个反应的标准焓变。应用盖斯定律,我们可以这样解答:
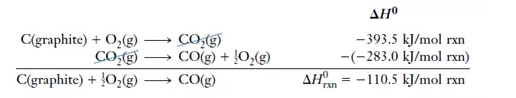
在利用Hess‘s Law时需要注意两点:
1.如果需要将一个反应的反应方向逆转(就是反应物变为产物,而产物变为反应物),那么一定记得改变ΔH的正负符号。
2.如果需要改变一个反应中的反应物和产物的摩尔数时,ΔH也要做相应比例的调整。
以上就是A+小编关于AP化学知识点中Thermochemistry的讲解,同学们在AP课程学习中如果还有什么不明白的地方,可以随时咨询A+国际教育课程辅导老师,让老师一对一帮助你实现AP成绩的提升吧!
 喜欢 [0]
喜欢 [0] 相关推荐

猜你喜欢 More

2019-10-09
alevel课程是什么,英国上alevel年龄限制是怎样的
2022-05-05
IBDP的成绩被哪些大学认可?
2024-03-08
Alevel数学难吗?alevel数学相当于国内什么难度?
2019-06-28
alevel进阶数学教材电子版及内容和目录大纲













 官方微信
官方微信

 官方微博
官方微博
