AP化学知识点之酸碱平衡中PH计算方法讲解
在AP化学知识点学习中,酸碱平衡这部分是非常重要的一部分,却也往往是很多同学们公认的一大难点。因为除开理论知识外,这部分内容还会涉及很多负载的计算过程,其中PH计算就是很多同学们非常难易掌握的一个内容。下面A+国际教育小编就为大家简单讲解一下这部分内容。

总体来说,凡是涉及到pH计算的题目,首先要确定该溶液是单一成分还是酸碱滴定过程中的混合溶液。对于单一组成的溶液,无非就是求某酸(不管是强酸还是弱酸)或者某碱(不管是强碱还是弱碱),再或者酸碱滴定到达equivalence point(等量点)时,也就是求某盐溶液的pH。
如果是求混合溶液的pH,那一般是求在滴定过程中的pH,可能是在equivalencepoint之前,也可能是在equivalence point之后,所以,下面我们分别针对单一成分的溶液和混合溶液的pH分类探讨:
一.单一成分溶液的pH
1、强酸强碱的pH
首先,根据pH的定义,
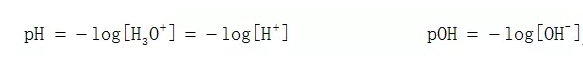
所以,求pH的关键就是求出H+的浓度,而强酸强碱是完全电离的,因此,对于一元强酸来说,[H+]就等于酸的浓度。比如,对于200 ml,0.01 mol/L的HCl来说,[H+]=[HCl]=0.01 mol/L,所以其pH=-log 0.01=2。
如果给的是二元酸,比如H2SO4,那么[H+]就等于酸浓度的两倍。
如果给的是强碱溶液,那么求pH要利用这个结论,并且一般有两种计算方法,比如求,500 ml,0.01 mol/L的KOH溶液的pH:
a.[OH-]=[KOH]=0.01 mol/L pOH=-log 0.01=2 pH=14-pOH=12
b.根据KW的值求出[H+]=KW/[OH-]=1*10-14/0.01=10-12 pH=-log 10-12=12
2、弱酸或弱碱的pH
一般求滴定曲线初始pH值时,我们要先计算出被滴定的弱酸或者弱碱电离出来的[H+]。弱酸弱碱都是发生部分电离的,所以一般根据它们的电离平衡方程式,借助Ka,Kb的值,利用ICE三段式求算即可。
比如AP的一道freeresponse:
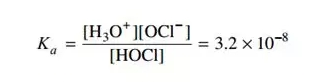

对于(b)我们可以用ICE解答如下:
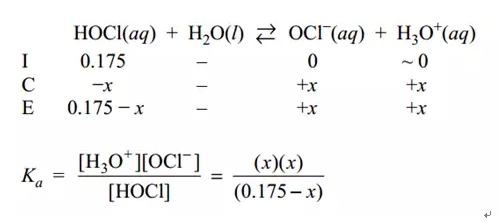
解出x即可。
同样的方法求弱碱的pOH。
3、单一盐溶液的pH
一般都是求酸碱滴定过程到达equivalence point时的pH,此时酸碱恰好中和反应,溶液中只存在一种盐。如果是强酸强碱的滴定,那很简单,pH=7。
如果是用强碱滴定弱酸,或者强酸滴定弱碱,那么此时生成的盐由于会发生水解(Hydrolysis)而导致pH大于7或者小于7,具体求算需要借助共轭酸碱对(Conjugate Acid-base Pair)的平衡常数之积等于KW,即KW=Ka*Kb。
比如用NaOH滴定某弱酸HX到达equivalence point时,溶液中只有NaX,要想求此时的pH,那么第一步写出该弱酸根离子X-的水解方程式:
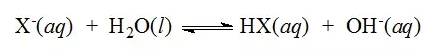
此水解平衡常数为Kb,Kb=KW/Ka(Hx),然后列ICE求出OH-的浓度。一定要记住此水解平衡对应的平衡常数应为Kb不等于弱酸HX的Ka。
二.混合溶液的pH
AP考试中出现的混合溶液一般就是缓冲溶液(Buffer Solution),也就是在到达equivalence point之前。此时的混合溶液是由未反应完的弱酸HX与已经被NaOH中和掉而生成的NaX组成的,所以这样一对共轭酸碱对形成的混合溶液就是缓冲溶液。所以,简单一点的话,直接根据加入的NaOH的物质的量得到NaX的量,再求出剩余的HX的量,然后代入缓冲溶液pH计算公式:
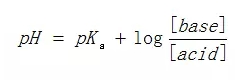
([base]即[X-],[acid]即[HX])
麻烦一点的话,也可以列HX的电离平衡方程式,把HX和NaX的初始浓度代入,用ICE去求H3O+的平衡浓度。
比如下面的(ii):

根据HCIO和NaOH各自的物质的量可以判断NaOH不能完全中和掉HCIO,所以我们可以分别求出剩余HCIO此时的浓度为0.0245 mol/L,生成的NaClO的浓度为0.107 mol/L,然后直接利用缓冲溶液pH计算公式求出此时的pH,然后根据[H3O+]=10-pH求出答案。也可以利用ICE:
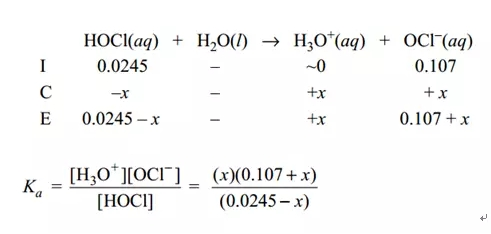
求出此时的x。
比较这两种方法,直接利用缓冲溶液pH计算公式可以更快速的求出答案。所以,一旦判断出来混合溶液是缓冲溶液,最好直接利用公式进行计算,减少出错率。
2.当酸碱滴定到达equivalencepoint之后,再继续滴加NaOH,那此时的混合溶液就是中和反应生成的盐与过量的NaOH形成的混合溶液,这种情况下,我们一般直接根据过量的NaOH此时的浓度去计算[OH-]的浓度,然后求出pOH,再去求pH,忽略掉盐溶液的水解对pH的影响。
以上就是A+小编关于AP化学知识点中单一溶液以及混合溶液的pH计算方法的讲解,大家是不是已经掌握了呢?如果在AP课程学习中还存在什么疑问,一定要及时反馈给A+国际教育课程老师,让老师一对一的辅导你开展课程的学习,这样学习起来才能事半功倍哟!
 喜欢 [0]
喜欢 [0] 推荐课程
相关推荐

猜你喜欢 More

2019-12-12
在考前几个月中,如何学好Alevel生物?
2019-07-24
IB课程难度:IB课程难吗?IB课程难不难?
2020-10-16
关于GCSE心理学课程的一些学习指导分享
2020-04-10
AP学习方法攻略分享,想要拿高分你得这么学!















 官方微信
官方微信

 官方微博
官方微博
