在AP化学中,化学动力学(kinetics)属于化学中的 physical chemistry,也是AP化学知识点中的必考内容。今天A加未来小编就带大家来总结一下AP化学动力学部分的重要考点,一起来了解一下吧!
如果同学们能把这里归纳的有关定律和公式理解并掌握,在应付AP考试中的相关题目时就会觉得轻松自如,希望大家争取把这部分的分数全部拿到。

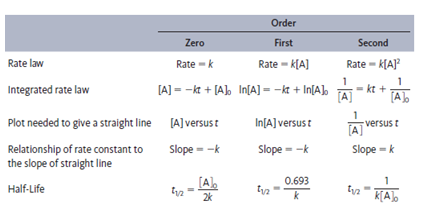
首先,化学反应的速率可以由不同形式的方程表示,分为 average rate equation,instantaneous rate equation 和 integrated rate equation。
Average rate equation 是一段时间内的平均反应速率方程,可以用反应物或产物在一段时间内的浓度变化与反应时间的比值表示。注意,为了使用同一个反应中的不同反应物或产物表达出的数值相同,还需要除以各物质在方程式中的系数。
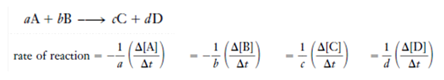
Instantaneous rate equation 表达的是某一时刻所对应的反应速率方程,一般表达成反应速率与反应物在某时刻浓度的关系。其中,反应物浓度的指数之和为整个反应的 reaction order(反应级数),不一定等于方程式中的系数。Reaction order 是由实验所测定的。
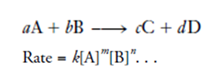
Integrated rate equation 所表达的是反应物浓度与反应时间的关系。对于反应级数不同的化学反应,其 integrated rate equation 有不同的形式。
影响化学反应速率的因素很多,主要可以总结如下:

大并且复杂的反应物分子的反应速率要小于小的分子;反应速率随温度升高和反应物浓度增大而加快;均相反应的速率大于异相反应;催化剂能加快反应进行。
其中,温度对反应速率的影响是通过影响反应速率常数的形式实现的,其关系可以用 the Arrheniuse quation 表示:
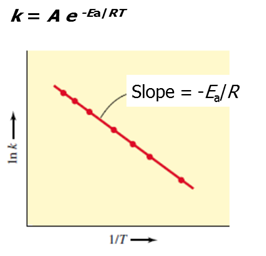
Catalyst 对反应速率的影响是通过降低反应的 activation energy(Ea)的形式实现的,Ea 与反应速率常数的关系也体现在了 the Arrhenius equation中。
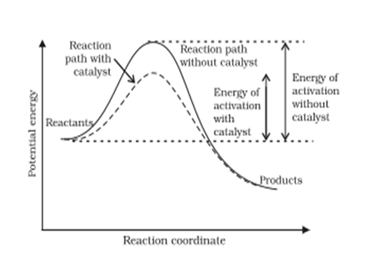
在 Kinetics 这部分还需要掌握化学反应的 collision theory(碰撞理论),包括两点主要内容:

能够使反应进行的 collision 称作 effective collision,其条件是需要有一定的能量(activation energy),反应物 particle 之间需要保持正确的取向。
在 Kinetics 这部分,AP化学要求掌握 reaction mechanism,因为篇幅有限,这里不做论述。